Os componentes químicos são semelhantes em todos os seres vivos, podendo ser divididos em dois grupos.
No passado, os químicos definiram substâncias orgânicas como sendo aquelas que só poderiam ser fabricadas e encontradas no interior dos seres vivos, enquanto as substâncias inorgânicas seriam encontradas também, fora dos seres vivos. Em 1928 Woler conseguiu sintetizar, pela primeira vez, uma molécula orgânica em laboratório, a ureia (componente da urina) a partir de um composto inorgânico, o cianeto de amônio. Tal feito tornou esses conceitos inadequados para os tempos atuais e sendo assim, modernamente, consideramos substâncias orgânicas como sendo aquelas cuja estrutura molecular está fundamentada em uma cadeia de carbonos. O gráfico a seguir nos dá ideia da porcentagem média das substâncias encontradas nas células dos seres vivos.
A água é o componente mais abundante das células, sua molécula é formada por dois átomos de hidrogênio ligados a um átomo de oxigênio(H2O). Suas propriedades permitem que ela tenha várias funções nos seres vivos:
- Solvente de várias substâncias químicas possibilitando o seu transporte e distribuição no interior das células e fora delas, além de facilitar o intercâmbio entre os meios intracelular e extracelular.
- Facilita a ocorrência de reações químicas.
- Atua como reagente em várias reações químicas, principalmente reações de síntese por desidratação e reações de quebra por hidrólise.
- Ajuda a manter a temperatura corporal, em nível compatível com a vida, ou seja, participa da regulação térmica dos seres vivos.
- Atua com lubrificante, diminuindo o atrito entre tecidos e órgãos.
Espécies diferente podem apresentar diferentes porcentagens do seu peso em água, por exemplo: o homem 63%, fungos 83%, águas-vivas 98% e sementes de 10 a 20%. De qualquer modo, a quantidade de água não pode variar muito, No homem por exemplo, a perda de 10% do total da água, em 24 horas, leva á morte.
Sais minerais:
Os sais minerais podem ser encontrados nos seres vivos de duas maneiras diferentes:
- Insolúveis: neste caso estão na forma molecular e imobilizados fazendo parte de estruturas esqueléticas, como os fosfatos de cálcio que fazem parte dos ossos dos vertebrados, conferindo-lhes dureza e resistência, carbonatos de cálcio nos corais de recife e sais de silício em certas algas.
- Solúveis: encontram-se na forma iônica e dissolvidos em água, sendo importantes em vários fenômenos e reações químicas.
 |
| Alguns íons encontrados nos seres vivos e suas respectivas funções. |
Os carboidratos são moléculas orgânicas formadas por átomos de carbono, hidrogênio e oxigênio. Também são conhecidos como glicídios, glucídios, açúcares, sacarídeos ou hidratos de carbono. Podem ser divididos em três grandes grupos: monossacarídeos, dissacarídeos e polissacarídeos.
- Monossacarídeos: são os carboidratos mais simples e podem ser representados pela fórmula geral Cn(H2O)n, sendo que n pode variar de 3 até 7. Os monossacarídeos são classificados de acordo com o número de átomos de carbono. Os monossacarídeos mais importantes são as pentoses e hexoses.
 |
| Exemplos de monossacarídeos. |
 |
| As principais pentoses. |
 |
| As principais hexoses. |
- Dissacarídeos: os dissacarídeos são moléculas formadas pela ligação entre dois monossacarídeos. Esta ligação é do tipo síntese por desidratação, ou seja, os dois monossacarídeos se unem, liberando uma molécula de água.
 |
| Os principais dissacarídeos. |
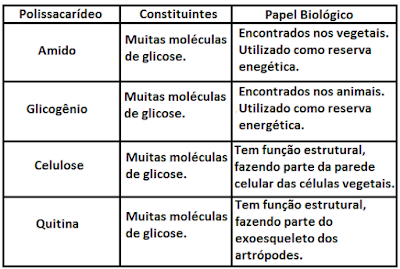
- Polissacarídeos: os polissacarídeos são macromoléculas, formadas por centenas ou milhares de monossacarídeos, ligados entre si, através de síntese por desidratação.
Os lipídios são moléculas orgânicas, formadas pela associação entre ácidos graxos e um álcool orgânico. Sua principal característica é a insolubilidade em água e a solubilidade em solventes orgânicos como a benzina, o éter e o álcool etílico. Os lipídios são divididos em dois grupos principais: os lipídios simples e os lipídios complexos.
Lipídios simples:
Apresentam em sua constituição apenas átomos de carbono, hidrogênio e oxigênio. Podem ser três tipos diferentes: glicerídeos, cerídeos e esterídeos.
- Glicerídeos: também denominados triglicérides. São formados por três ácidos graxos, ligados a uma molécula de glicerol (álcool de três carbonos). Em temperatura ambiente( em torno de 20º), os glicídios que se apresentam sólidos são denominados gorduras e os que se apresentam líquidos são denominados óleos. Animais armazenam gordura e os vegetais armazenam óleo como reserva energética. Além disso, a gordura, armazenada sob a pele das aves e dos mamíferos (animais homeotermos) tem importante papel isolante térmico, ajudando a manter a temperatura corporal.
- Cerídeos: também denominados ceras, são formados por ácidos graxos ligados a um álcool, de cadeia mais longa que o glicerol. São extremamente insolúveis em água, e por isso, utilizados como impermeabilizantes de folhas e frutos nos vegetais, evitando a desidratação excessiva. Nos animais podemos citar a cera produzida e utilizada pelas abelhas como material de construção da sua colmeia.
- Esterídeos: também denominados esteroides, são bem diferentes dos demais lipídios, sendo formados pela união de ácidos graxos com álcoois de cadeia fechada denominados esteróis. O esteroide mais conhecido é o colesterol, presente nas membranas celulares e precursor dos hormônios sexuais: a testosterona (masculino), o estrógeno e a progesterona (femininos).
Apresentam em sua formação, além dos átomos de carbono, hidrogênio e o oxigênio que aparecem nos lipídios simples, átomos de fósforo ou nitrogênio. Veja abaixo os principais:
- Fosfolipídios: apresentam fosfato em sua constituição e fazem parte da constituição da membrana plasmática das células em geral.
- Esfingolipídios: apresentam nitrogênio na sua constituição e são abundantes no tecido nervoso (esfingomielina), onde formam a bainha de mielina que envolve os neurônios, funcionando como isolante elétrico.
As proteínas são macromoléculas, de elevado peso molecular, formadas por unidades que são denominadas aminoácidos. As proteínas são, portanto, polímeros e os aminoácidos, monômeros. As proteínas são os compostos orgânicos de maior abundancia na matéria viva (10-15%) e na composição total de um ser vivo só perde para a água (75-85%).
Aminoácidos: os aminoácidos são moléculas orgânicas que possuem um carbono central (carbono α), ao qual se ligam um átomo de hidrogênio (— H), um grupamento amina(—NH2), um grupamento carboxila (— COOH) e um radical (— R). Conhecemos hoje cerca de 20 tipos diferentes de aminoácidos, que fazem parte da constituição das proteínas dos seres vivos. É o radical que caracteriza e diferencia os aminoácidos, já que os outros componentes da molécula são idênticos em todos eles.
 |
| Alguns exemplos de aminoácidos. |
Os aminoácidos de um organismo podem ser classificados em dois tipos: os essenciais, que ele não consegue sintetizar, tendo que obrigatoriamente consegui-los através de sua dieta alimentar e os naturais que ele pode produzir. Os vegetais e algumas bactérias conseguem fabricar todos os aminoácidos. Já os animais conseguem fabricar apenas alguns.
Ligação peptídica: as proteínas são formadas por dezenas de moléculas de aminoácidos ligados entre si, através de ligações denominadas peptídicas. Uma ligação peptídica consiste na união entre o carbono do grupo carboxila de um aminoácido, com a liberação de uma molécula de água.
A identidade de uma proteína: três fatores podem diferencias uma proteína da outra:
Estruturas das proteínas: quando se considera apenas a sequencia linear de aminoácidos ligados uns aos outros, por ligações peptídicas, fala-se em estrutura primária. À medida que o filamento proteico vai sendo produzido ele vai se dobrando, devido à atração existente entre os aminoácidos (pontes de hidrogênio), dando à molécula uma forma helicoidal, denominada estrutura secundária. A proteína então, dobra-se sobre si mesma formando a estrutura terciária. Algumas proteínas podem ser formadas por duas ou mais cadeias polipeptídicas, unidas entre si, formando, o que denominamos estrutura quaternária.
Tipos de proteínas:
A desnaturação ou desnaturação proteica: já sabemos que a sequencia de aminoácidos a função desempenha pela proteína. É importante salientar que a forma final da proteína (estruturada terciária ou quaternária) também está associada à funcionalidade de uma proteína.
Quando uma proteína se deforma, perdendo a sua funcionalidade, dizemos que ela está desnaturada. A desnaturação de um proteína pode ser um processo irreversível. Dois fatores principais, levam a desnaturação proteica:
Para manter-se viva, uma célula precisa realizar reações químicas bastante complexas, em baixa temperatura e alta velocidade. No meio extracelular estas mesmas reações seriam lentar e exigiriam temperaturas elevadas, o que levaria à desnaturação proteica. Para que estas reações aconteçam na velocidade e temperatura compatíveis com a vida, as enzimas atuam como biocatalizadores, ou seja, aceleradores de reações.
Frequentemente, a nomenclatura das enzimas é baseada no substrato, que é a molécula sobre a qual a enzima atua, acrescentando-se o final ase.
Fatores que interferem na ação enzimática:
Chamamos de imunização a capacidade de se criar imunidade, ou seja, resistência a agentes invasores do organismo. Estes agentes invasores são chamados antígenos. Esta resistência resulta da produção de anticorpos por células do tecido sanguíneo, denominadas glóbulos brancos do tipo linfócitos.
Os anticorpos são específicos e capazes de reconhecer e ligar-se aos antígenos, inativando-os e facilitando a sua destruição.
Tipos de imunização:
 |
| Aminoácidos essenciais e naturais da espécie humana. |
Ligação peptídica: as proteínas são formadas por dezenas de moléculas de aminoácidos ligados entre si, através de ligações denominadas peptídicas. Uma ligação peptídica consiste na união entre o carbono do grupo carboxila de um aminoácido, com a liberação de uma molécula de água.
 |
| Ligação peptídica entre dois aminoácidos. |
Dois aminoácidos unidos formam um dipeptídio, três formam um tripeptídios e vários formam um polipeptídio. Para que um polipeptídio possa ser considerado uma proteína ele deve ser capaz de executar alguma função.
A identidade de uma proteína: três fatores podem diferencias uma proteína da outra:
- Os tipos de aminoácidos.
- O número de aminoácidos.
- A sequencia de aminoácidos.
Estruturas das proteínas: quando se considera apenas a sequencia linear de aminoácidos ligados uns aos outros, por ligações peptídicas, fala-se em estrutura primária. À medida que o filamento proteico vai sendo produzido ele vai se dobrando, devido à atração existente entre os aminoácidos (pontes de hidrogênio), dando à molécula uma forma helicoidal, denominada estrutura secundária. A proteína então, dobra-se sobre si mesma formando a estrutura terciária. Algumas proteínas podem ser formadas por duas ou mais cadeias polipeptídicas, unidas entre si, formando, o que denominamos estrutura quaternária.
 |
| As diferentes formas estruturais das proteínas. |
- Proteínas simples: constituídas apenas por cadeias polipeptídicas.
- Proteínas conjugadas: ocorre principalmente em enzimas e são constituídas por uma parte proteica denominada apoenzima e outra não proteica denominada coenzima ou grupo prostético. A apoenzima sozinha não é ativa.
Quando uma proteína se deforma, perdendo a sua funcionalidade, dizemos que ela está desnaturada. A desnaturação de um proteína pode ser um processo irreversível. Dois fatores principais, levam a desnaturação proteica:
- O calor excessivo (a partir de 45º) rompe as ligações que mantem a forma terciária da proteína. Podemos citar, como exemplo, o que ocorre com a clara do ovo, que apresenta grande quantidade de uma proteína denominada albumina dissolvida em água. Em condições naturais a clara se apresenta líquida e transparente. Com o cozimento, ela se torna sólida e opaca, porque as proteínas desnaturadas enrolam-se umas nas outras tornando-se insolúveis em água, solidificando-se.
- A variação muito ampla do pH, ou seja, em meio muito ácido ou muito básico, ocorre o rompimento de ligações que ajudam a manter a forma terciária das proteínas. Isto ocorre, por exemplo, na fabricação de queijos e iogurtes: acrescenta-se ao leite bactérias fermentadoras (lactobacilos), que liberam o ácido láctico, que acidificando ao leite, desnaturam suas proteínas, as quais se solidificam.
- Estrutural: são fundamentais na estrutura dos seres vivos, participando da arquitetura e consistência das células, além de dar sustentação aos tecidos através de fibras que se distribuem por entre as células.
 |
| Exemplos de proteínas com função estrutural. |
- Hormonal: hormônios são substancias de várias naturezas químicas (lipídios e proteínas, principalmente) produzidas por determinadas glândulas, denominadas endócrinas. Estas substancias podem estimular ou inibir a atividade de um órgão. Como exemplo de uma proteína que atue como hormônio podemos citar a insulina, produzida pelo pâncreas e que regula o metabolismo do açúcar.
- Nutritiva: as proteínas podem ser utilizadas como fonte de aminoácidos (principalmente os essenciais), na dieta animal, para que ele( o animal) possa produzir suas próprias proteínas. Em certos casos, algumas proteínas podem ser utilizadas como fonte de energia para o metabolismo celular.
- Enzimática: as enzimas são proteínas especiais, que atuam como catalisadores, ou seja, aceleram e regulam reações químicas que ocorrem nas células.
- Defesa: algumas proteínas atuam como anticorpos, que compõe o sistema imunológico, responsável pela defesa do corpo. Vamos estudar a ação enzimática e a imunologia com detalhes.
Para manter-se viva, uma célula precisa realizar reações químicas bastante complexas, em baixa temperatura e alta velocidade. No meio extracelular estas mesmas reações seriam lentar e exigiriam temperaturas elevadas, o que levaria à desnaturação proteica. Para que estas reações aconteçam na velocidade e temperatura compatíveis com a vida, as enzimas atuam como biocatalizadores, ou seja, aceleradores de reações.
Frequentemente, a nomenclatura das enzimas é baseada no substrato, que é a molécula sobre a qual a enzima atua, acrescentando-se o final ase.
 |
| As enzimas são denominadas em função do substrato. |
As enzimas são altamente específicas. Cada tipo de reação química que ocorre na célula é catalisada por um tipo de enzima. Esta especificidade deve-se ao fato da molécula da enzima encaixar-se perfeitamente na molécula do substrato, como uma chave de sua fechadura.
Note que após catalisar a reação, a enzima se desprende e permanece inalterada, podendo se combinar à outra molécula de substrato. Isto significa que a enzima não é consumida durante a reação.Fatores que interferem na ação enzimática:
- Temperatura: a velocidade da reação enzimática tende a aumentar com o aumento da temperatura do meio onde a enzima atua. Geralmente, a cada 10º de elevação da temperatura do ambiente, ocorre duplicação ou triplicação da atividade enzimática. No entanto existe um limite para essa influencia da temperatura, pois enzimas são proteínas e portanto, em temperaturas elevadas, sofrem desnaturação, perdendo a capacidade de atuação adequada. A temperatura limite para a atividade enzimática varia de acordo com a espécie de ser vivo, mas de maneira geral fica em torno de 40º.
- pH: cada enzima tem um pH ótimo, no qual a velocidade da reação catalisada é máxima. Em pH mais ácido ou mais básico a atividade enzimática diminui. Observe que o pH ótimo varia de acordo com a enzima. Normalmente, a inibição da atividade enzimática pelo pH é reversível. Se submetermos, por exemplo, uma enzima de pH ácido a um meio onde o pH esteja alcalino, a velocidade da reação diminui, mas se voltarmos a enzima para o pH ácido a velocidade de ração aumenta novamente. Porém, em pH muito ácido, algumas enzimas podem sofrer desnaturação, perdendo definitivamente a capacidade de atuar.
- Concentração do substrato: Se mantivermos constante a concentração de uma determinada enzima e ao mesmo tempo aumentarmos a concentração de substrato,vamos verificar que a velocidade de reação vai sofrendo aumentos progressivamente menores, até atingir um ponto, no qual novos aumentos (da concentração do substrato) não elevam mais a velocidade de reação, atingindo-se a saturação da concentração do substrato.
Chamamos de imunização a capacidade de se criar imunidade, ou seja, resistência a agentes invasores do organismo. Estes agentes invasores são chamados antígenos. Esta resistência resulta da produção de anticorpos por células do tecido sanguíneo, denominadas glóbulos brancos do tipo linfócitos.
Os anticorpos são específicos e capazes de reconhecer e ligar-se aos antígenos, inativando-os e facilitando a sua destruição.
Tipos de imunização:
- Ativa: neste caso o corpo produz os anticorpos. Pode ser de dois tipos:
- Naturalmente Adquirida: O organismo adquire o antígeno e fabrica anticorpos contra ele, tornando-se imune. Por exemplo, se uma pessoa contrai o vírus do sarampo, ela passa a fabricar os anticorpos e depois torna-se imune a essa doença.
- Artificialmente Adquirida: é o que chamamos de Vacina. Inocula-se no organismo antígenos atenuados, quer dizer, enfraquecidos a ponto de não causarem doença. O organismo estimulado pela vacina "aprende" a produzir os anticorpos e passa a ser imune ao antígeno. A vacinação é portanto, uma maneira de combate preventivo à doença. Quando um organismo é exposto, uma segunda vez, a um determinado antígeno, a produção de anticorpos ocorre com maior rapidez e intensidade.
- Passiva: o organismo recebe os anticorpos prontos. Também pode ser de dois tipos:
- Naturalmente Adquirida: ocorre em mamíferos como o ser humano, por exemplo. A mãe transfere anticorpos para o embrião através da placenta e depois para o recém-nascido através do leite materno.
- Artificialmente Adquirida: é o que chamamos de Soro. É utilizado quando o antígeno age rapidamente, não dando tempo ao organismo de produzir anticorpos. É o que ocorre quando uma pessoa é picada por cobras. Injeta-se soro com anticorpos prontos para anular rapidamente a ação do veneno. Note que ao contrário da vacina o soro não tem ação preventiva, mas sim curativa ou terapêutica.




Nenhum comentário:
Postar um comentário